图片新闻
有性生殖在真核生物的繁衍与演化中扮演着重要的角色,其在不同物种中表现出丰富的多样性。关于有性生殖的调控过程,尽管在动物、植物和真菌等真核生物中均有研究,但系统性的、深入到分子机制层面的研究仅局限在少数生物中。模式生物四膜虫是一种具有七种性别(交配型)的原生动物,代表了一类进化上起源较早的单细胞真核生物。其作为模式生物的特点及其进化地位,为系统、深入地阐明真核生物早期分化类群的有性生殖调控过程,探讨真核生物有性生殖的起源与演化提供了机会。
中国科学院水生生物研究所缪炜研究员团队对四膜虫有性生殖的调控开展了十多年的系统研究。相继发现了四膜虫交配型决定基因(PLOS Biology,2013)并揭示了其起源与演化规律(iScience,2021),解析了多个细胞周期蛋白、周期蛋白激酶和转录因子在有性生殖减数分裂过程中的调控作用(JCS,2020;Cell cycle,2016a/b/c,2018)。近期,通过对四膜虫有性生殖调控过程的持续研究,团队在交配型识别、有性生殖起始和减数分裂同源重组三个方面取得了重要研究进展(图1),为解答真核生物性别起源、同性和异性识别等重要的进化生物学问题提供了线索。
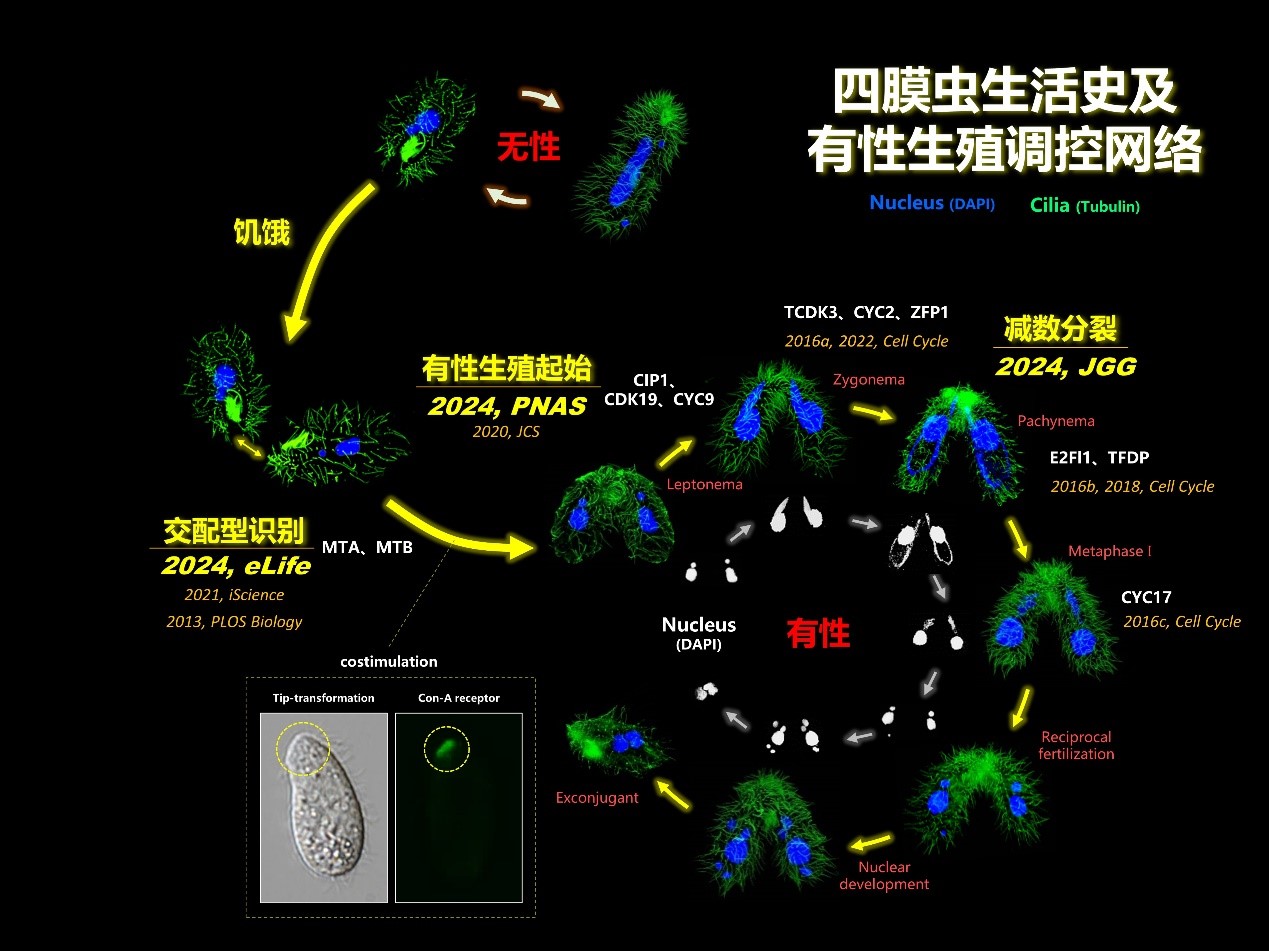
图1 四膜虫生活史及有性生殖调控网络研究进展
1.性别产生之前真核生物如何进行有性生殖?
真核生物具有有性生殖的标志是减数分裂。由于减数分裂相关基因在真核生物普遍存在并具有保守性,说明减数分裂起源早,在真核生物共同祖先中已存在。而不同的生物,采用的性别决定基因具有很大差别,说明性别在进化上产生较晚且在不同真核生物类群中具有较大差异。而进化上从减数分裂起源到第一次性别产生的中间状态,真核生物如何进行有性生殖并不明确。相关假说认为在此期间,真核生物采用单性生殖,即同种细胞配对(自交,selfing)。
水生所缪炜团队近期在对四膜虫有性生殖起始过程研究发现,名为CIP1的单一基因的缺失可使四膜虫跳过交配型识别过程而直接启动减数分裂。研究发现敲除CIP1导致交配型识别的自交规避功能丧失。CIP1通过抑制细胞周期蛋白-周期蛋白激酶复合体(CDK19-CYC9)阻止有性生殖的启动,负责将有性生殖起始与交配型识别两个过程相耦联。这一结果表明单个基因的起源这类简单的进化事件即可导致生物从自交变为不同性别的异交。这一结果支持真核生物祖先采用自交(单性)进行有性生殖。
近日,这一工作以“Cip1,a CDK regulator,determines heterothallic mating or homothallic selfing in a protist”为题在线发表于PNAS杂志。水生所马扬博士和闫冠雄博士为该文共同第一作者,缪炜研究员为通讯作者。
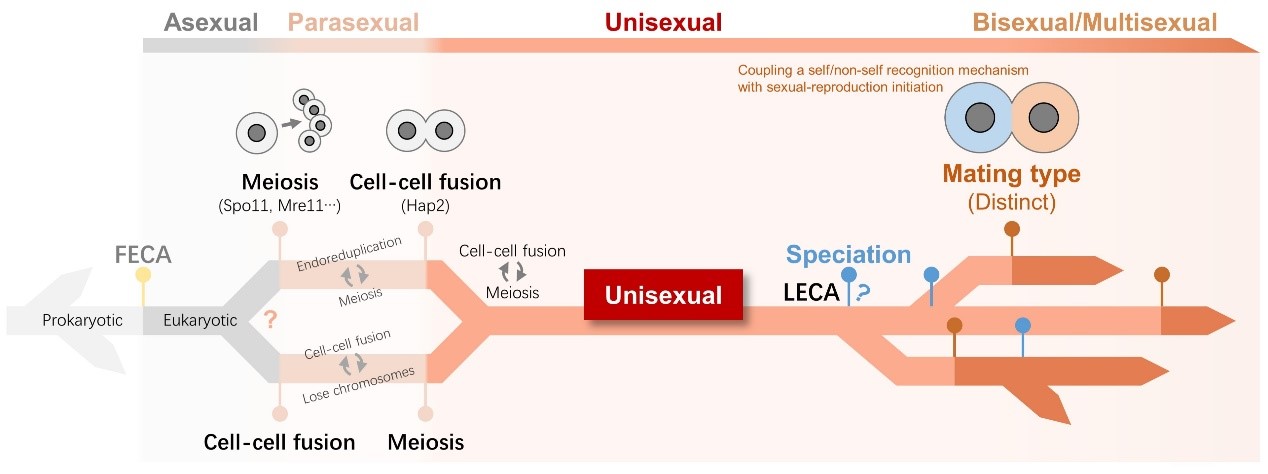
图2真核生物有性生殖起源假说示意图
2.单细胞生物如何识别同性和异性?
尽管大多数常见的生物仅具有两种性别(雌/雄、+/-、a/α等),多性别的物种同样普遍存在于自然界中,如一些原生动物纤毛虫(Ciliates)和担子菌(basidiomycetes)。模式纤毛虫嗜热四膜虫具有七种交配型(I-VII)。缪炜研究员团队前期与加州大学圣塔芭芭拉分校Eduardo Orias教授合作发现,这七种交配型的分子基础为MTA和MTB两个蛋白家族。然而,七种交配型之间如何进行同性和异性的识别依然是悬而未决的问题。
近期,通过与华中农业大学殷平教授团队合作,发现四膜虫交配型识别过程中,MTA和MTB并非进行简单的配体-受体反应,而是与一系列蛋白共同形成一个巨大的复合体来行使功能。该复合体定位于细胞表面而非纤毛表面,且围绕在纤毛周围,沿纤毛列排布。该复合体一方面可以识别同性从而抑制配对,另一方面可以识别异性从而激活配对,即同时具有自我识别和非自我识别的能力。
相关工作以“A seven-sex species recognizes self and non-self mating-type via a novel protein complex”为题发表于eLife杂志。水生所闫冠雄博士为该文第一作者,水生所缪炜研究员与华中农业大学殷平教授为共同通讯作者。

图3四膜虫交配型识别模型
3.没有联会复合体的生物有着怎样的减数分裂同源重组模式?
减数分裂同源重组是有性生殖的一个重要过程,不仅能够确保亲本的染色体正常地分配到配子中,而且影响基因组的多样性和生物的适应性演化,因此长期以来同源重组一直是生物学研究的热点,然而在古老的进化分支如单细胞原生动物纤毛虫中的减数分裂重组模式却鲜有报道。
缪炜研究员团队以高密度的单核苷酸多态性位点(3.8 SNPs/kb)作为分子标记,在嗜热四膜虫38个杂交后代中共检测到1,021个交叉互换(Crossover)事件,对应基因组重组率为9.9 cM/Mb,该重组率远高于人、小鼠和拟南芥等高等动植物;但基因转换(Gene conversion)事件较为罕见,每次减数分裂仅1.03个,且不存在G/C偏好性转换;未发现明显的交叉干扰迹象,可能与四膜虫减数分裂过程缺乏联会复合体有关;此外,重组热点常出现在着丝粒或亚端粒区域,并且与响应环境变化的基因密切相关。该研究解析了联会复合体缺失物种的减数分裂同源重组模式,为染色体交叉互换的调控机制及重组机器在不同生物类群中的演化机制提供了新的视角和研究方案。
该研究工作以“The genome-wide meiotic recombination landscape in ciliates and its implications for crossover regulation and genome evolution”为题并作为封面论文发表于Journal of Genetics and Genomics杂志。水生所付露博士为该论文第一作者,缪炜研究员和王光营博士为共同通讯作者。

图4 Journal of Genetics and Genomics 2024年第51卷第3期封面
上述三项工作得到了国家重点研发计划、中国科学院先导专项、中国科学院基础前沿科学研究计划“从0到1”原始创新项目和国家自然科学基金的资助,以及水生所分析测试中心、中国科学院超级计算武汉分中心和国家水生生物种质资源库的支持。美国杜克大学孙晟副教授,美国加州大学圣塔芭芭拉分校Eduardo Orias教授、Eileen P. Hamilton博士,法国蒙彼利埃大学国家科学研究中心人类遗传学研究所Kazufumi Mochizuki教授参与了相关工作并提出了宝贵意见。
文章链接:
PNAS论文: https://www.pnas.org/doi/10.1073/pnas.2315531121
eLife论文:https://elifesciences.org/reviewed-preprints/93770
Journal of Genetics and Genomics论文:https://doi.org/10.1016/j.jgg.2023.09.013

 新闻
新闻