11月29日,精密测量院胡蕴菲、李从刚课题组联合北京大学金长文课题组在GPCR- -arrestin信号通路动态研究中取得新进展,首次在残基水平上展示了PIP2独立激活 -arrestin蛋白的特有机制,并检测到了可能代表了激活中间态的低比例构象。相关研究近日在国际期刊《自然通讯》(Nature Communications)上在线发表。
G蛋白偶联受体(GPCR)是最大的细胞膜表面受体家族和最重要的药物靶标。 -arrestin蛋白是GPCR信号传导途径下游的支架蛋白和信号调节因子,它能被磷酸化的GPCR激活,参与GPCR的脱敏、内吞、循环等生理过程,并能够介导独立于G蛋白的细胞内信号通路,对多种重要疾病的进程有重要影响。在人体中仅存在两种 -arrestin蛋白,它们不仅要接收来自800多种不同的GPCR所传递的信号,还能够引发多样的下游效应。 -Arrestin蛋白功能上的多样性是由于其结构的高度动态性。目前,尽管 -arrestin蛋白在非激活态和激活态结构是已知的,但它们仅代表了起始终止时的稳定构象;而对 -arrestin蛋白激活过程中的构象动态变化,尤其是对受体磷酸化尾巴和细胞膜磷脂组分引起 -arrestin的激活机制的异同,仍然缺乏足够的理解。国际上对相关方面的研究尚处于起步阶段。
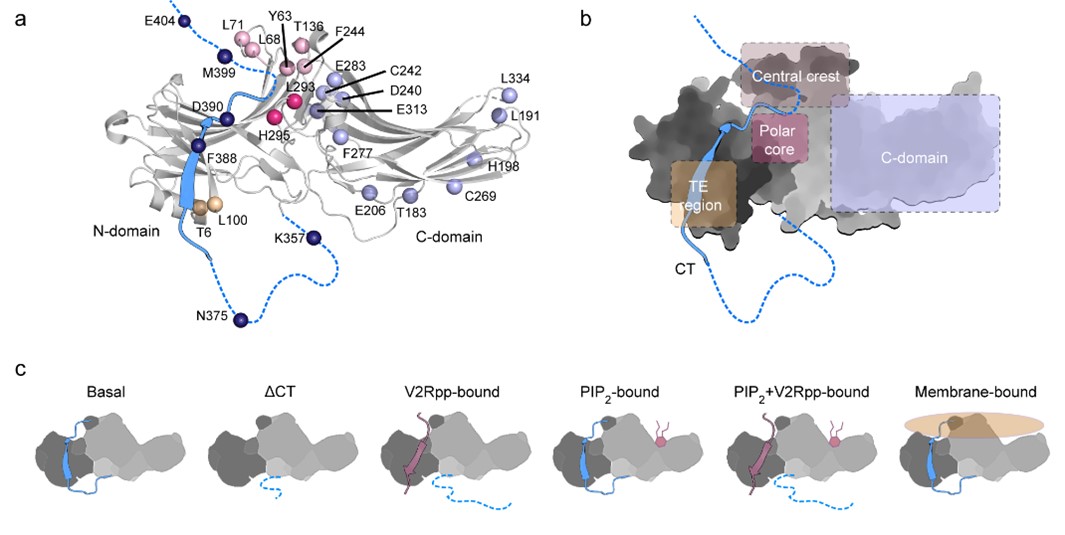
-arrestin-1蛋白突变体库的构建和本论文研究的不同功能状态

19F NMR方法检测 -arrestin-1蛋白动态构象变化
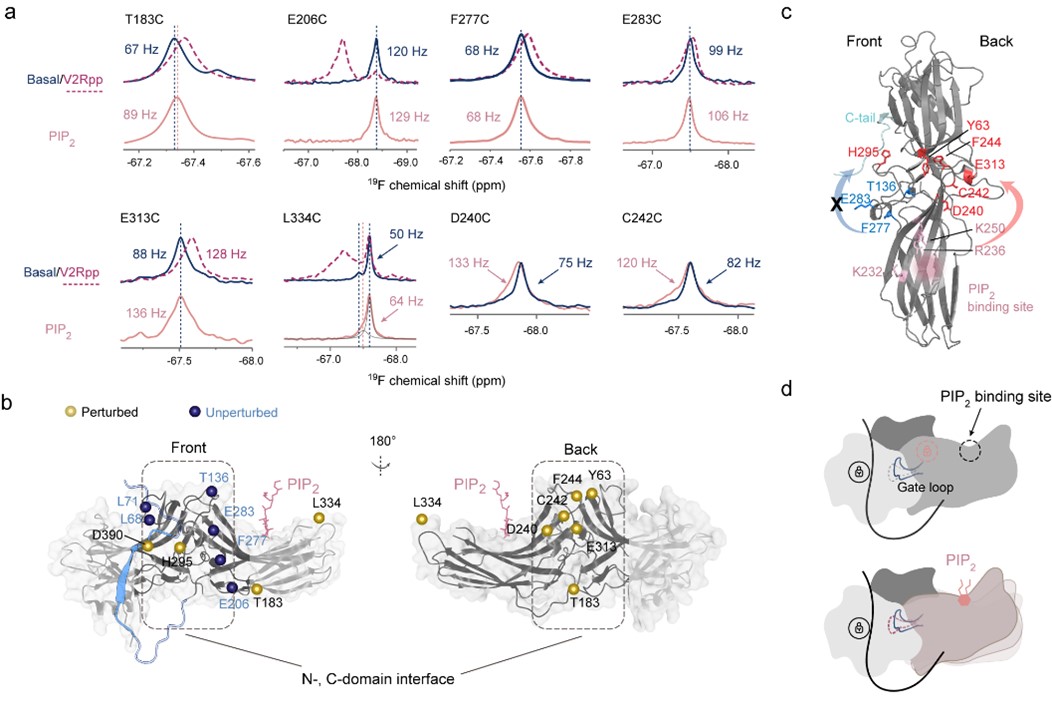
19F NMR方法揭示PIP2激活 -arrestin-1蛋白的分子机制
液体核磁共振方法能够在原子分辨率水平上研究蛋白质相互作用和构象变化,提供静态结构中缺失的信息,是研究GPCR- -arrestin信号通路动态结构变化与激活机制不可缺少的核心手段。该项研究对 -arrestin-1蛋白进行了系统突变,构建了一个覆盖所有重要结构区域的突变体库(图一),进而引入新型19F同位素探针,检测 -arrestin-1在结合不同的受体磷酸化肽段和细胞膜上的4,5-二磷酸磷脂酰肌醇(PIP2)时的核磁图谱变化(图二),分析 -arrestin-1与不同组分结合时产生的构象变化,揭示了两种不同激活模式的分子机制。该项研究首次在残基水平上展示了PIP2 独立激活 -arrestin蛋白的特有机制(图三),并检测到了可能代表了激活中间态的低比例构象。研究还揭示了PIP2 、受体磷酸化肽段以及磷脂双分子层在调控 -arrestin-1构象平衡中的相互关系,揭示了 -arrestin蛋白功能多样性的分子机制,为进一步针对该通路进行基于动态结构的药物研发提供了理论基础。
该研究以“应用19F核磁共振方法揭示 -抑制蛋白不同激活机制(Distinct activation mechanisms of -arrestin 1 revealed by 19F NMR spectroscopy)” 为题在《自然通讯》(Nature Communications)上发表。由北京大学生命科学学院博士生翟睿博(第一作者)在教授金长文和研究员胡蕴菲(共同通讯作者)的共同指导下完成。分子动力学模拟工作由北京大学化学学院博士生王卓琦完成。新型19F探针由精密测量院研究员李从刚和博士柴兆斐提供。19F CEST NMR实验由北京大学核磁共振中心博士牛晓刚完成。该研究得到了武汉-北京磁共振联合实验室的大力支持。
论文链接:https://doi.org/10.1038/s41467-023-43694-1