工作动态
原始生殖细胞(primordial germ cell, PGC)是精子和卵子在胚胎期的祖先细胞(progenitor cell),是遗传物质代际传递的细胞载体。因此,PGC是开展基因编辑和转基因等遗传操作的理想靶细胞。将遗传操作后的PGC移植入内源PGC剔除的受体胚,利用受体高效产生遗传操作的供体配子,一方面可以显著提升遗传操作的效率,有望获得致死基因的母源合子突变体(J Genet Genomics,2020;Faculty of 1000推荐);另一方面有可能通过跨物种的PGC移植实现种间借腹生殖(Science China Life Science, 2022),突破精准高效的定向育种。因此PGC移植技术已成为动物遗传操作和定向育种领域亟待突破和发展的重要技术。
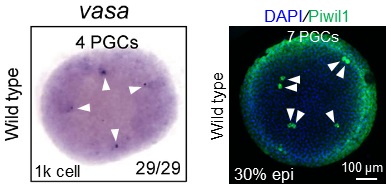
图1 斑马鱼等鱼类早期胚胎中仅存在极少数目的PGC
然而,供体胚胎往往仅具有极少数目的PGC,比如1000-细胞期的斑马鱼胚胎仅有4颗PGC(图1),严重限制了PGC移植的成功率。如何建立一种普适高效的PGC诱导技术,成为这一领域亟待解决的首要科学和技术难题。在动物界,PGC特化存在两种不同的模式:一种是以小鼠为代表的“后成论(Epigenesis)”,是指周围信号诱导细胞团获得PGC特性;另一种是以果蝇、秀丽隐杆线虫、斑马鱼和非洲爪蟾为代表的“先成论(Preformation)”,是指从母体继承的生殖质(germplasm)因子直接决定了生殖细胞命运。在“后成论”动物中,已有少量诱导型PGC(induced PGC,iPGC)成功的报道(Nature,2013;Science,2022),但在“先成论”动物中尚没有取得iPGC的突破。
中国科学院水生生物研究所孙永华团队长期从事鱼类生殖细胞发育与生物技术研究。前期以斑马鱼和稀有鮈鲫为模型,初步建立了鱼类单因子PGC异位诱导(J Genet Genomics,2020;Faculty of 1000推荐)和跨亚科物种间生殖干细胞移植借腹生殖(Science China Life Science, 2022)技术。12月14日,孙永华团队在国际学术期刊Nature Communications发表了题为“Induced formation of primordial germ cells from zebrafish blastomeres by germplasm factors”的研究论文,首次采用“先成论”策略在斑马鱼和稀有鮈鲫胚胎中高效诱导出iPGC,为硬骨鱼类的PGC诱导和PGC移植借腹生殖建立了一个新范式。

为了高效地诱导鱼类PGC,作者首先将与PGC特化密切相关的9个生殖质因子(9GM:ddx4,dazl,piwil1,dnd1,nanos3,tdrd6,tdrd7a, dazap2,buc)和与PGC迁移相关的4个因子(4GM:rgs14a,cxcr4a,cxcr4b,ca15b)一同注射到1-细胞的斑马鱼胚胎中,发现几乎所有胚盘细胞都变成GFP-UTRnanos3阳性的类PGC细胞。去除与PGC迁移相关的4因子后,9GM仍能高效的诱导出类PGC细胞。将诱导的类PGC细胞移植到内源PGC剔除的受体胚中,类PGC可以正确迁移到生殖嵴(图2),且起始表达内源生殖质基因,表明这些类PGC具有典型的PGC特征,是真正的iPGC。

图2 9GM将斑马鱼胚盘细胞高效诱导为iPGC
接下来,研究人员使用Tg(cmv:GFP)和Tg(cmv:mCherry)转基因胚胎分别作为iPGC移植的供体和受体。通过连续追踪iPGC移植性腺的发育,发现嵌合体性腺生殖细胞均表达GFP,性腺体细胞均表达mCherry。最终,利用表达mCherry的亲本产出了表达GFP的iPGC移植配子,其子代也能正常发育和繁殖。这表明,iPGC移植后能够正常发育为成熟的配子。为了进一步证明9个生殖质因子能够将任何一个胚胎细胞诱导为iPGC,作者尝试将9GM注射入128-细胞时期的斑马鱼胚胎的单个胚盘细胞中,发现无论注射到动物极,还是胚盘边缘的单胚盘细胞,9GM均能将该胚盘细胞诱导为iPGC,并进一步产生功能性配子,这表明9GM能够将任一胚盘细胞诱导成为iPGC。
重要的是,这种诱导策略在不同鱼类间高度保守。作者发现,斑马鱼来源的9GM也能将稀有鮈鲫胚盘细胞高效诱导为iPGC;将稀有鮈鲫iPGC移植入斑马鱼胚胎后,可以利用斑马鱼高效产出稀有鮈鲫iPGC来源的种间借腹生殖精子(图3)。

图3 稀有鮈鲫iPGC的高效诱导和iPGC移植种间借腹生殖
最后,作者试图利用iPGC诱导和移植技术来解决鱼类基因敲入实验中面临的一个致命难题——即基因敲入效率与胚胎存活率之间的矛盾。作者注射大剂量的基因敲入元件,以在囊胚期获得尽可能高的基因敲入效率;通过注射9GM,将这些携带有大量基因敲入事件却无法存活的胚胎细胞全部诱导为iPGC;再将这些iPGC移植入野生型受体胚胎,最终利用高存活率的野生型受体鱼高效产生出了基因敲入的配子(图4)。基因敲入与iPGC诱导结合实验的成功,从根本上提升了斑马鱼基因敲入实验中的种系传递效率。
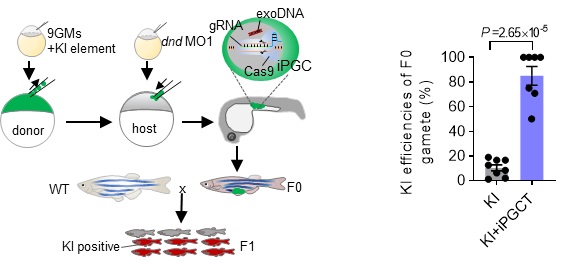
图4 通过iPGC诱导和移植显著提升基因敲入的种系传递效率
这一鱼类iPGC诱导理论和技术的突破,真正解决了鱼类PGC移植中供体PGC来源的瓶颈,不仅为斑马鱼等鱼类基因功能研究提供了更为强大的工具,而且可用于养殖鱼类的iPGC移植高效借腹生殖精准育种。相关成果发表于Nature Communications杂志,中国科学院水生生物研究所王小四特别研究助理为论文第一作者,祝俊雯博士、王厚鹏工程师等参与该项研究,孙永华研究员为通讯作者。论文链接:https://www.nature.com/articles/s41467-023-43587-3。这项研究受到国家杰出青年科学基金、国家自然科学基金创新研究群体项目、国家重点研发计划项目、中国博士后科学基金等资助。据悉,文中用到的斑马鱼和稀有鮈鲫来自于国家水生生物种质资源库国家斑马鱼资源中心,相关载体也已保藏至该中心,并通过该中心对学术界提供相关资源和技术服务。
附:斑马鱼iPGC高效诱导和移植实验视频
参考文献:
Wang, X., Zhu, J., Wang, H., Deng, W., Jiao, S., Wang, Y., He, M., Zhang, F., Liu, T., Hao, Y., Ye, D., and Sun, Y.* (2023). Induced formation of primordial germ cells from zebrafish blastomeres by germplasm factors. Nature Communications 10.1038/s41467-023-43587-3.
Zhang, F., Li, X., He, M., Ye, D., Xiong, F., Amin, G., Zhu, Z., and Sun, Y.* (2020). Efficient generation of zebrafish maternal-zygotic mutants through transplantation of ectopically induced and Cas9/gRNA targeted primordial germ cells. Journal of Genetics and Genomics 47, 37-47. (Faculty 1000推荐论文)
Zhang, F., Hao, Y., Li, X., Li, Y., Ye, D., Zhang, R., Wang, X., He, M., Wang, H., Zhu, Z., and Sun, Y.* (2022). Surrogate production of genome-edited sperm from a different subfamily by spermatogonial stem cell transplantation. Science China. Life sciences 65, 969-987.
Nakaki, F. et al. (2013) Induction of mouse germ-cell fate by transcription factors in vitro. Nature 501, 222-226.
Oikawa, M. et al. (2022) Functional primordial germ cell-like cells from pluripotent stem cells in rats. Science 376, 176-179.

 科技服务
科技服务